苑天彤,姜 雪,李 雪,王宏杨
(1黑龙江省中医医院南岗分院·黑龙江 哈尔滨 150001;2黑龙江中医药大学· 黑龙江 哈尔滨 150040)
中药何首乌主要药效成份以 2,3,5,4′-四羟基二苯乙烯-2-O-β-D 葡糖苷 (简称二苯乙烯苷,2,3,5,4′-tetrahydroxystilbene-2-O-β-D-glucoside,TSG)作为其定量指标[1-2]。研究显示TSG具有抗氧化作用,且不伴肝毒性[3-4]。本课题组的前期工作亦提示,TSG 通过干预DN大鼠肾组织 NO-ONOO-氧化途径,明显减少微量蛋白尿,减轻肾小管损伤,对肾脏早期损伤有保护作用[5-8]。本实验探讨了TSG 对中晚期 DN 大鼠肾脏保护作用及机制。
1.1 实验动物 健康8周龄SPF级雄性Wistar大鼠40只,体质量(180±20)g,购自哈尔滨市松北区翔林养殖场,合格证号:SCXK(黑)2013-001,大鼠分笼饲养,每笼5只。自由进水、进食。适应性饲养1 周。
1.2 药品和试剂 二苯乙烯苷(TSG):中国科学院成都生物研究所研制,纯度:99.44%,产品批号:MUST-18051611。链脲佐菌素(STZ):Sigma公司,货号:S0130。血肌酐测量试剂盒:南京建成生物研究所。Rabbit Anti-VWF、聚合HRP标记抗兔IgG:武汉博士德生物有限公司。Trizol Reagent、PrimeScript RT reagent Kit with gDNA Erase、TB Green Premix Ex Taq II:TAKARA。
1.3 主要实验仪器 罗康全血糖仪:德国罗氏诊断技术有限公司;LD5-2A型低速离心机:北京京立离心机有限公司;325病理切片机:德国Zeiss公司;Boxun电热鼓风干燥箱:上海博讯医疗生物仪器有限公司;YT-6C生物组织摊考片机:MDF-382E-80℃冰箱:日本SANYO公司;CFX96Real-time PCR仪:Bio-Rad。
2.1 动物造模与分组给药 雄性 Wistar 大鼠40 只,随机分为2 组:正常对照组10只,余 30 只高糖高脂饲料(普通饲料78.8%、胆固醇1%、牛胆盐0.2%、蛋黄粉10%、猪油10%)喂养 8 周, 30 mg/kg STZ 尾静脉注射(临用前用 0.1mol/L、 pH 4.4 已配制的枸橼酸缓冲液溶解,浓度 2%)。注射 STZ 72 h 后,大鼠尾静脉取血检测血糖,连续3 d非空腹血糖≥16.7 mmol/L 为 DM大鼠模型成功[9]。30只大鼠24只成模,随机分为DN 组12只、TSG组12只。TSG组大鼠每天腹腔注射浓度1%的TSG溶液(30 mg/kg溶于生理盐水)8周,正常组、模型组腹腔注射等量生理盐水。实验观察20周,正常组大鼠死亡1只,模型组、TSG组大鼠均死亡4只。
2.2 观察指标及检测
2.2.1 尿UALB/UCr、血SCr测定 实验20 周末,用代谢笼收集24 h 尿液,散色比浊发测定UALB、UCr,计算UALB/UCr。末次给药后禁食水12 h,用10%的水合氯醛腹腔注射麻醉,腹主动脉采血,离心,分离血清,生化分析仪检测GLU、SCr。
2.2.2 肾组织vWF表达的免疫组化检测 腹主动脉采血后处死大鼠,取肾组织放10%的甲醛固定液中用于免疫组化的检测;应用Image-pro plus6.0病理图像分析系统对阳性表达定量分析,每组每只大鼠肾脏组织标本随机抽取5个高倍镜下视野(×400),棕黄色颗粒为阳性表达,以光密度(IOD)代表蛋白的表达量。IOD=阳性的面积×平均的光密度,并取其均值作为该片子的相对表达量。
2.2.3 肾组织SUR2B/Kir6.1mRNA表达的Real-Time PCR测定 取肾脏组织加入1 mL Trizol 按试剂盒说明提取RNA。
cDNA的合成根据primeScriptTMRT Master Mix 要求操作。取1μLRNA溶液在PCR仪器上70 ℃温度下孵育5 min,静置在冰盒上冷却;在溶液中加逆转录反应体系并使其混合均匀,PCR仪上与37 ℃反应15 min,然后85 ℃反应10 s,迅速将其降温至4 ℃,将其逆转录为cDNA,-80 ℃冰箱中保存以备使用。qPCR:测量cDNA的浓度,将其定量为100 mg/L在1.5 mL的离心管中将其配置成n+1个混合体系。如下:取0.2 mL的PCR管,按照19μL将其每个分装,分别加入cDNA的模板1μL,瞬时进行离心后将其轻摇混匀,然后瞬时将其离心。将QPCR仪器设置好,开始PCR扩增(95 ℃,10 s;95℃,5 s,40 cycles;55 ℃,10 s,40 cycles;72 ℃,15 s,40 cycles;4 ℃,+∞)。引物序列见表1。以GAPDH为内参,整理并将数据导出。

表1 PCR引物序列
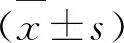
3.1 实验第20 周各组大鼠UALB/UCr、SCr比较 见表2。
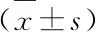
表2 实验第20周各组大鼠UALB/UCr、SCr比较
3.2 实验第20 周各组大鼠肾组织vWF表达比较 见图1,表3。

图1 各组大鼠实验第20 周肾组织vWF表达的免疫组化测定(×400)

表3 实验第20周各组大鼠肾组织vWF表达比较
3.3 实验第20 周各组大鼠肾组织SUR2B/Kir6.1mRNA表达的RT-PCR检测结果 见表4。
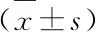
表4 实验第20周各组大鼠肾组织SUR2B mRNA、Kri6.1 mRNA表达比较
众所周知高血糖导致的代谢紊乱、炎症反应、氧化应激等引起血管内皮细胞受损,内皮细胞合成的血管性血友病因子(von Willebrand Factor,vWF),在血管内皮细胞损伤时释放入血,主要介导血小板与血管内皮黏附,促进血栓形成,引起血流动力学异常,血流动力学异常是DN进展至终末期肾病的重要机制[10]。ATP敏感性钾离子通道(ATP-sensitive K+ channels,KATP)是由内向整流亚基(Kir)和调节性磺脲受体(sulfony urea receptor,SUR)组合而成的八聚体,SUR可感受细胞内ATP/ADP 浓度的变化,进而通过KATP通道开放或关闭,调整NO生成和释放,缓解血液动力学异常,改善血管内皮细胞功能紊乱。肾脏存在不同的KATP通道,且KATP通道在肾脏生理调节过程中,对维持钾离子的稳态和肾脏微血管张力起着重要作用[11]。在病理状态下,KATP结构和功能的改变与肾功能的改变密切相关[12-13]。本实验结果显示,与模型组相比,TSG 组肾组织vWF 表达减弱、SUR2B/Kir6.1mRNA表达量增加,提示TSG可能通过干预ATP敏感性钾离子通道SUR2B/Kir6.1亚型基因水平上的表达,改善血流动力学异常,保护肾脏血管内皮,延缓DN进程。
猜你喜欢苯乙烯免疫组化内皮细胞夏枯草水提液对实验性自身免疫性甲状腺炎的治疗作用及机制研究浙江医学(2020年9期)2020-07-01浅议角膜内皮细胞检查中国眼镜科技杂志(2019年9期)2019-11-11婴幼儿原始黏液样间叶性肿瘤一例及文献复习浙江中西医结合杂志(2019年4期)2019-05-05结直肠癌组织中SOX9与RUNX1表达及其临床意义浙江医学(2019年2期)2019-01-23雌激素治疗保护去卵巢对血管内皮细胞损伤的初步机制安徽医科大学学报(2016年12期)2017-01-15子宫瘢痕妊娠的病理免疫组化特点分析中国继续医学教育(2015年1期)2016-01-06细胞微泡miRNA对内皮细胞的调控中国病理生理杂志(2015年8期)2015-12-21苯乙烯装置塔系热集成化工进展(2015年6期)2015-11-13中国8月苯乙烯进口量26万t,为16个月以来最低世界热带农业信息(2014年11期)2015-01-05痰瘀与血管内皮细胞的关系研究云南中医学院学报(2014年5期)2014-07-31