刘青松 马懿


摘 要:以花色苷、卵磷脂和胆固醇为原料,壳聚糖溶液加以修饰,用薄膜超声法制备花色苷脂质体,待水化一段时间加入壳聚糖溶液,制备花色苷壳聚糖脂质体,高速离心机离心,测吸光度之差,算出脂质体的包封率,以包封率为质量指标。通过单因素实验确定工艺中对脂质体包封率的影响因素,确定最佳方案,正交实验确定脂质体的最佳生产工艺为:制备温度40°C、卵磷脂加入量100mg、胆固醇加入量33mg、花色苷加入量1.25mg,在此条件下包封率达到40.2%。
实验利用温度、金属离子来研究花色苷以及脂质体的稳定性,采用DPPH法研究花色苷的抗氧化性,花色苷在低温稳定,高温降解率极高,通过对比花色苷与脂质体在同样温度下的降解率,可以发现脂质体的降解率比花色苷低,也验证了脂质体可以提高包封药物稳定性的特性,金属离子实验发现,花色苷及脂质体最好不要与铜、铁物体接触。而DPPH法测得的结果曲线也显示出花色苷有着良好的抗氧化性。
关键词:黑加仑花色苷;壳聚糖;脂质体;稳定性;抗氧化性;包封率
ABSTRACT:To anthocyanins, lecithin and cholesterol as raw material, chitosan solution to decorate, anthocyanins liposomes with thin film prepared by ultrasound, stay hydrated for a period of time to join the chitosan solution, preparation of anthocyanins liposome chitosan, high-speed centrifuge, the difference between the measured absorbance, calculate the liposome envelopment rate, quality indicators for coating rate. The factors affecting the encapsulation rate of liposomes in the process were determined by single factor experiment, and the optimal scheme was determined. The optimal production process of liposomes was determined by orthogonal experiment:
the preparation temperature was 40°C, the amount of lecithin added was 100mg, the amount of cholesterol added was 33mg, and the amount of anthocyanin added was 1.25mg. Under this condition, the encapsulation rate reached 40.2%.
Experimental temperature, metal ion is used to study the anthocyanins stability of liposomes, and DPPH method is used to study the oxidation resistance of anthocyanins, anthocyanins stability at low temperature, high temperature degradation rate is extremely high, by comparing the anthocyanins liposome and degradation rate under the same temperature, can be found that the degradation of liposome rate is lower than the anthocyanins, also verified the liposome can improve the properties of coating drug stability, metal ions, it was found that anthocyanins and liposome is best not to contact with copper, iron objects. The results obtained by DPPH method also showed that anthocyanins had good antioxidant properties.
Keywords:
blackcurrant anthocyanins; Chitosan; Liposomes. Stability; Oxidation resistance; The encapsulation rate
1.材料與方法
1.1材料与仪器
卵磷脂、无水乙醇、胆固醇、壳聚糖、氯化钙、氯化钠、氯化亚铁、氯化铜、磷酸二氢钠磷酸氢二钠、1,1-二苯基-2-三硝基苯肼。
SHB-Ⅲ型循环水式多用真空泵 郑州长城科工贸有限公司;RE-52系列旋转蒸发器 上海亚荣生化仪器厂;TGL-21台式高速多功能冷冻离心机 上海百典仪器设备有限公司。
1.2试验方法
1.2.1目标脂质体制备方法
称取100mg大豆卵磷脂于烧杯中,再称取25mg胆固醇于烧杯中,用10ml量筒称取10ml无水乙醇加入烧杯中。在水浴型超声仪中超声3min,使膜材更好的溶解。将超声好的膜材溶液装进500ml旋蒸瓶中,在40°C的水浴温度下,60r/min旋转速度减压蒸发除去无水乙醇,直到旋蒸瓶上形成一层磷脂膜,停止旋转蒸发。将带有磷脂膜的旋蒸瓶放入超声仪中超声1min帮助磷脂膜脱落,再加入10ml含有花色苷(黑加仑提取物)的磷酸缓冲液,继续水浴超声3min,转移进锥形瓶中静置1h,使其充分水化。取含有静置1h以上的花色苷脂质体混悬液的锥形瓶,[1]将40ml的0.2%壳聚糖溶液[2]缓慢滴加到锥形瓶中,一边滴加一边震荡混匀,待0.2%的壳聚糖溶液全部滴加完毕时,利用玻璃棒搅拌2min中以上,时间越长效果越好,锥形瓶中应该含有50ml液体,不足50ml时补加到50ml,将锥形瓶中的溶液转移到50ml的尖底离心管中,做好顺序标识,为了稳定,在4°C的冰箱中保存一晚,方便第二天测定脂质体的包封率。
1.2.2測定方法
取制备的花色苷壳聚糖脂质体悬浮液加入到50ml离心管中,在10000r/min转速下离心10min,取上清液后,再次在10000r/min离心5min取出上清液,与同样方式离心得到的空白脂质体为参比,在紫外分光分度计上测定上清液的吸光度,代入花色苷标准曲线,得出未被包封的花色苷浓度[3]。
花色苷壳聚糖脂质体包封率计算公式:
包封率=(1-A/B)×100% (1-1)
A为游离花色苷的量,B为总花色苷的量
利用DPPH法测定花色苷及脂质体的抗氧化性。DPPH溶液配制:实验表明DPPH溶液浓度最好在20~70umol/L[4],本文配制100umol/L DPPH溶液。具体过程如下:称取9.85mg的DPPH溶解于乙醇,用250ml的容量瓶定容。
取2.0ml不同浓度的花色苷溶液与2.0mlDPPH溶液混匀,避光恒温放置1h,用乙醇做参比,利用紫外分光光度计分别测定517nm时的吸光度A1;2.0ml花色苷溶液和2.0ml乙醇混合物的吸光度A2;2.0mlDPPH溶液和2.0ml乙醇混合物的吸光度A[5]3。
其中:A1:样品溶液+DPPH溶液的吸光度值;A2:样品溶液+无水乙醇的吸光度;A3:DPPH溶液+无水乙醇的吸光度。
1.2.3单因素试验
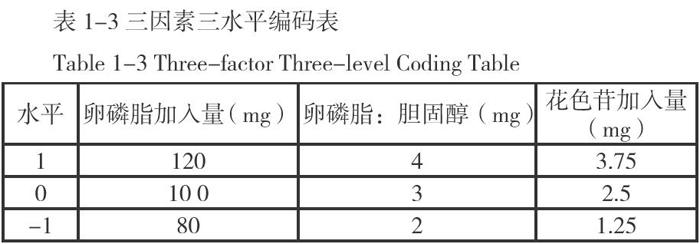
确定胆固醇加入量为30mg,花色苷加入量为5mg,壳聚糖的质量分数为0.2%,卵磷脂加入量分别为:60mg、80mg、100mg、120mg、140mg,编号并进行5组试验,每组3个平行实验;选取卵磷脂加入量为120mg。确定卵磷脂加入量为120mg,花色苷加入量为5mg,壳聚糖的质量分数为0.2%,卵磷脂加入量:胆固醇加入量分别为:2、3、4、5、6,编号并进行5组试验,每组3次平行实验;考虑优化实验,选取卵磷脂加入量:胆固醇加入量为3。确定卵磷脂加入量为120mg,胆固醇加入量为40mg,壳聚糖的质量分数为0.2%,花色苷加入量分别为:2.5mg、5.0mg、7.5mg、10mg、12.5mg,编号并进行5组实验,每组3次平行实验;确定花色苷加入量为2.5mg。
1.2.4正交试验与结果分析
2.结果与分析
2.1花色苷标准曲线
以黑加仑提取物的浓度对应吸光度绘制花色苷PBS溶液标准曲线如图3-1所示。
黑加仑花色苷浓度与吸光度的回归方程:y=0.2815x-0.007,相关系数R2=0.9997.表明花色苷浓度在0.125-4mg/ml范围内呈良好的线性关系。
2.2单因素试验结果
由图可以看出随着卵磷脂加入量的增加,脂质体的包封率先上升后下降,考虑优化实验,选取卵磷脂加入量为120mg。随着卵磷脂:胆固醇的比例上升,脂质体的包封率先上升后下降,考虑优化实验,选取卵磷脂加入量:胆固醇加入量为3。随着花色苷加入量的增加,脂质体的包封率一直下降,为进一步优化实验,确定花色苷加入量为2.5mg。
2.3正交试验结果与分析
由以上数据经过一系列计算绘制方差分析表如下:
由上表可知:卵磷脂加入量在0.8-1.2g之间影响不显著,卵磷脂加入量:胆固醇加入量比值在2、3、4之间也不显著,而花色苷加入量对于脂质体的包封率有严重影响,经过正交实验确定花色苷壳聚糖脂质体的最优制作工艺为:卵磷脂加入量为100mg,胆固醇加入量为33mg,花色苷加入量为1.25mg。
2.4温度对花色苷及脂质体的影响
由图可知,低温基本不影响花色苷的稳定性,而高温对花色苷稳定性有极其严重的破坏性。温度在常温时:花色苷的稳定性比较稳定,花色苷的降解率一直在3%以下,随着时间的增加,花色苷的稳定性一直保持良好;
2.5金属离子对花色苷及脂质体的影响
综上实验颜色改变及推断:在制备和储存时花色苷及花色苷壳聚糖脂质体时,一定要避免和含铜、铁的物体接触。
2.6花色苷的抗氧化试验
由上图可知:花色苷对于自由基的清除有着优秀的能力,在花色苷浓度还比较低时,清除率不高,随着花色苷的浓度的增加,花色苷的清除率呈直线上升,由此可以验证花色苷有着优秀的抗氧化性的能力。
3结论
经过正交实验结果分析花色苷壳聚糖脂质体的最优方案为100mg卵磷脂加入量、33mg胆固醇加入量、1.25mg花色苷加入量,在40°C的水浴中利用旋转蒸发仪制备花色苷脂质体,待水化2H后加入壳聚糖溶液,制备成功花色苷壳聚糖脂质体。花色苷壳聚糖脂质体的包封率为40.2%。
经过温度与金属离子实验发现:花色苷低温条件稳定,高温条件极速降解。脂质体对花色苷包裹作用使花色苷在高温条件下稳定性提高,同样温度下的花色苷和被包裹的花色苷,未被包裹的花色苷的降解率是被包裹的花色苷的2倍,金属离子实验让我明白花色苷或花色苷脂质体不能接触铜、铁容器。利用DPPH法测定花色苷的抗氧化性,确定花色苷具有很强的清除自由基的能力。并且随着花色苷浓度增加而增强,在实验设定的范围内能达到88.2%的清除率。
参考文献
[1] 邓英杰.磷脂与脂质体技术.人民卫生出版社,2007:166
[2] 严佳蕾,王小永.壳聚糖修饰脂质体对姜黄素的包载作用[J].中国测试,2016,42(9):61-66
[3] 赵圣书.黑加仑花色苷脂质体制备及功能评价[D].黑龙江:东北林业大学,2013:13
[4] Sharma o p.Bhat t k.DPPH antioxidant assay revisited. [J]. Food CHemistry, 2009.113(4);1202~1205.
[5] Sharma o p.Bhat t k.DPPH antioxidant assay revisited. [J]. Food CHemistry, 2009.113(4);1202~1205.
猜你喜欢脂质体抗氧化性壳聚糖叶酸靶向anti-miR-221阴离子脂质体的制备及体外抗肿瘤作用中国药房(2022年7期)2022-04-14高温下抗氧化性石墨涂层制备工艺探索科学与财富(2021年10期)2021-07-04高三尖杉酯碱类脂质体的制备及其稳定性中国药学药品知识仓库(2021年18期)2021-02-28脂质体研究进展及制备方法信息技术时代·上旬刊(2019年4期)2019-09-10微波辅助提取常春油麻藤花总黄酮工艺及其抗氧化性江苏农业科学(2016年8期)2017-02-15海洋真菌MF—08产壳聚糖酶诱导条件及酶学性质分析湖北农业科学(2016年7期)2016-05-14汽轮机油泥氧化生成方法的探索润滑油(2015年4期)2015-11-20用于巨型脂质体制备及收集的微流控芯片研究分析化学(2015年8期)2015-08-13毛蚶及其酶解产物的功能性评价和比较科技资讯(2015年7期)2015-07-02壳聚糖涂膜利于蓝莓保鲜农家顾问(2014年8期)2014-09-01