何傲月,赵 旭,郝 洁,史传道,刘启玲,孙 娜,曲传勇,张荣强
1陕西中医药大学公共卫生学院,陕西咸阳 712046 2宁夏回族自治区人民医院神经内科,银川 750002
肿瘤已成为影响全球公共健康的一大问题[1-3],中国在全球新发肿瘤病例中约占23%,在肿瘤导致的死亡病例中达到30%左右[4]。同时,居民因肿瘤导致的健康寿命损失,约为全球平均水平的两倍[5],因此,积极应对我国目前肿瘤疾病负担不断增加的态势已成为广大医务工作者的战略任务之一[6]。近年来,硒及硒蛋白与肿瘤的关系研究成为肿瘤防治领域的热点问题之一。硒是一种必需微量元素,具有提高人体免疫机能、甲状腺功能、保护修复细胞等多重生理功能。人体内硒蛋白是硒元素的生化功能的表达形式[7];
硫氧还蛋白还原酶(thioredoxin reductase,TXNRD)家族是硒蛋白的重要成员,主要发挥维持细胞内环境稳态、氧化还原平衡、抑癌等生物学作用[8-10]。该家族有3个成员:TXNRD1、TXNRD2、TXNRD3。TXNRD1主要存在于细胞质中,研究显示其在许多肿瘤中都高表达;
TXNRD2主要存在于线粒体中,它可以改善心功能,促进心肌细胞和肝细胞的生长;
TXNRD3主要存在于睾丸中,具有一定的青春期依赖性[11]。有报道TXNRD3具有催化氧化还原活性与广泛的底物特异性,当TXNRD3处于还原状态时,一旦正常细胞发展为癌细胞,可以调控细胞增殖、抑制细胞凋亡、促进肿瘤细胞的生长[12]。同时,TXNRD3高表达组的肿瘤侵袭力强,增殖速度快,凋亡率较低,转移力较强[13]。然而,上述研究均为单病种单基因的研究,受研究技术、样本含量等因素的影响,TXNRD3与肿瘤的关系尚无一致的结论,其作为肿瘤诊断和治疗标志物的潜力也鲜有报道。随着基因测序技术快速发展,泛癌研究逐渐兴起,开拓了肿瘤研究的视野,也弥补了单个肿瘤研究的不足,成为肿瘤研究的必然趋势[14-15]。本研究从硒蛋白基因TXNRD3出发,采用泛癌分析的思路,首先探讨其在人类33种恶性肿瘤中的表达情况,进一步分析其对33种肿瘤生存预后的影响,并探讨TXNRD3与肿瘤微环境中的免疫细胞及免疫浸润的相关性、免疫新抗原、免疫检查点、肿瘤突变负担和微卫星不稳定性,随后根据TXNRD3基因表达水平将样本分为高低表达组,并对其进行生物功能和信号通路的富集分析。通过上述分析旨在揭示TXNRD3对人类恶性肿瘤发生和发展的影响,为肿瘤的免疫治疗和预后预测提供新的靶点,有利于加速对于肿瘤分子生物学的理解,从而对肿瘤的预防诊断和治疗带来帮助。
数据来源硒蛋白基因TXNRD3在31种正常人体组织中的mRNA测序数据来自基因型-组织表达研究项目(genotype-tissue expression,GTEx)数据库(http://commonfund.nih.gov/GTEx),在21个肿瘤细胞系的表达数据来自癌症细胞系百科全书(cancer cell line encyclopedia,CCLE)数据库(https://portals.broadinstitute.org/ccle)。
TXNRD3在肿瘤组织的表达硒蛋白基因TXNRD3在27种肿瘤组织及癌旁组织的mRNA测序数据及临床信息数据来自癌症基因组图谱(the cancer genome atlas,TCGA)数据库(https://portal.gdc.cancer.gov)和GTEx数据集,为扩大部分肿瘤组织相对应的正常组织的样本数,将TCGA数据集与GTEx数据集进行合并,然后比较两组的TXNRD3表达情况。
肿瘤患者生存期预后分析基于TCGA数据库33种肿瘤组织TXNRD3表达数据,采用Kaplan-Meier分析TXNRD3对肿瘤患者生存预后的影响。首先将肿瘤组织中的TXNRD3表达水平通过二分法分为TXNRD3高表达组和TXNRD3低表达组,然后进行单变量Cox生存分析和Kaplan-Meier分析,通过R4.0.3软件进行数据可视化。
TXNRD3与肿瘤免疫浸润的相关性分析肿瘤免疫浸润细胞是一种具有抗原特性和浸润性的细胞群,主要作用是识别和防御恶性细胞,为探讨TXNRD3表达与不同类型肿瘤免疫浸润水平的关系,首先从TIMER数据库(https://cistrome.shinyapps.io/timer)下载33种肿瘤的6种免疫浸润细胞(B细胞、CD4+T细胞、CD8+T细胞、树突细胞、巨噬细胞、中性粒细胞)的得分数据,使用R软件包“estimate”分析,当P<0.05或R>0.20时,为相关性有统计学意义。
TXNRD3与免疫新抗原的相关性分析肿瘤新抗原是癌细胞产生的新抗原,它可以成为T细胞特异性攻击的靶点,从而杀死肿瘤细胞,主要由体细胞基因点突变、移码突变、插入缺失突变、基因融合等导致,可分别计算每个肿瘤样本的新抗原数量,探讨TXNRD3表达与抗原数量的关系,当P<0.05或R>0.20时,为相关性有统计学意义。
TXNRD3与肿瘤突变负荷和微卫星不稳定性的相关性分析肿瘤突变负荷(tumor mutational burden,TMB)可反映肿瘤细胞中所含有的突变数目,是一种可定量生物标志物。微卫星不稳定性(microsatellite instability,MSI)是由于重复单位的插入或缺失造成的肿瘤微卫星长度的任何改变,出现新的微卫星等位基因现象。采用Spearman相关分析33种肿瘤组织TXNRD3表达与TMB的相关性和TXNRD3表达与MSI的相关性。
TXNRD3表达与DNA修复基因的相关性分析DNA修复基因为细胞内的错配修复机制,该机制的关键DNA修复基因可以维持人体基因组的完整性与稳定性,这些基因丢失可能会导致DNA复制错误而难以被修复,使体细胞突变率较高,进而导致机体患癌。进一步利用TCGA的表达谱数据评估TXNRD3表达与5个DNA修复基因:MLH1、MSH2、MSH6、PMS2、EPCAM突变的相关性。
TXNRD3基因富集分析为观察TXNRD3表达对肿瘤的影响,根据基因表达水平将肿瘤样本分成高低两组,使用基因富集分析探寻TXNRD3高低表达组的KEGG和HALLMARK基因集的富集情况,了解TXNRD3在影响肿瘤发生和发展过程中涉及的信号通路。
TXNRD3在正常组织和肿瘤组织中的表达及分布基于GTEx数据集分析正常人体正常组织TXNRD3的表达水平,结果显示TXNRD3在31种正常组织中均有表达,但表达程度有差异(图1A)。随后根据组织来源分析从CCLE数据库下载的各个肿瘤细胞系的测序数据,结果显示TXNRD3在肿瘤细胞系的21种组织中均广泛表达但表达程度有差异(图1B)。从TCGA数据库中检索20种肿瘤样本中TXNRD3在癌变与邻近癌中的差异表达模式,显示大多数肿瘤在肿瘤组织中的TXNRD3的表达量高于正常组织(图1C)。此外,考虑到TCGA中的正常样本较少,又整合了GTEx数据库中的正常组织数据和TCGA肿瘤组织数据,进行27种肿瘤中TXNRD3表达差异分析,结果显示在肾上腺皮质癌、肾透明细胞癌(kidney renal clear cell carcinoma,KIRC)、卵巢浆液性囊腺癌、睾丸癌(testicular germ cell tumors,TGCT)、甲状腺癌(thyroid carcinoma,THCA)、子宫内膜癌(uterine corpus endometrial carcinoma,UCEC)肿瘤组织中TXNRD3的表达水平显著低于正常组织,而在膀胱尿路上皮癌、乳腺浸润癌(breast invasive carcinoma,BRCA)、胆管癌、结肠癌、胶质细胞瘤、头颈鳞状细胞癌(head and neck squamous cell carcinoma,HNSC)、肾乳头状细胞癌(kidney renal papillary cell carcinoma,KIRP)、急性髓细胞样白血病(acute myeloid leukemia,AML)、低级别胶质瘤(brain lower grade glioma,LGG)、肺腺癌、肺鳞癌(lung squamous cell carcinoma,LUSC)、胰腺癌(pancreatic adenocarcinoma,PAAD)、前列腺癌、直肠腺癌、皮肤黑色素瘤肿瘤组织中TXNRD3的表达水平明显高于正常组织(图1D)。
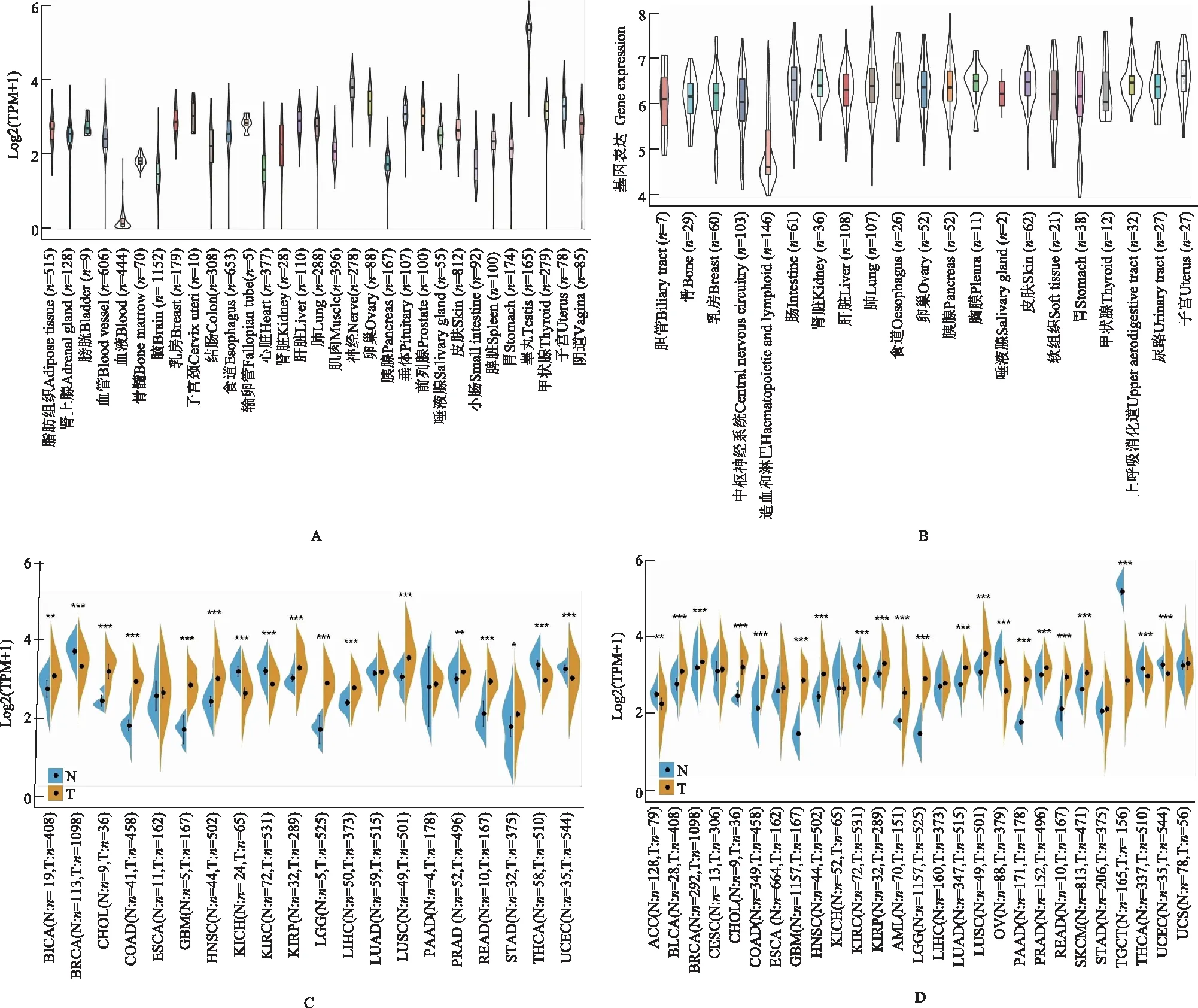
TXNRD3:硫氧还蛋白还原酶3;
BLCA:膀胱尿路上皮癌;
BRCA:乳腺浸润癌;
CHOL:胆管癌;
COAD:结肠癌;
ESCA:食管癌;
GBM:胶质细胞瘤;
HNSC:头颈鳞状细胞癌;
KICH:肾嫌色细胞癌;
KIRC:肾透明细胞癌;
KIRP:肾乳头状细胞癌;
LGG:低级别胶质瘤;
LIHC:肝细胞癌;
LUAD:肺腺癌;
LUSC:肺鳞癌;
PAAD:胰腺癌;
PRAD:前列腺癌;
READ:直肠腺癌;
STAD:胃癌;
THCA:甲状腺癌;
UCEC:子宫内膜癌;
ACC:肾上腺皮质癌;
CESC:宫颈鳞癌和腺癌;
AML:急性髓细胞样白血病;
OV:卵巢浆液性囊腺癌;
SKCM:皮肤黑色素瘤;
TGCT:睾丸癌;
UCS:子宫肉瘤;
N:正常;
T:肿瘤;
TPM:每百万转录本;
*P<0.05,**P<0.01,***P<0.001
TXNRD3对不同肿瘤的预后意义生存分析计算33种肿瘤的TXNRD3表达与总生存期的关系表明,TXNRD3可以显著影响KICH(HR=1.42,P=0.004)、PAAD(HR=1.14,P<0.001)、SARC(HR=1.06,P=0.016)、THCA(HR=1.20,P=0.046)、THYM(HR=1.10,P=0.035)、UCEC(HR=1.05,P=0.044)的总体生存率(图2),TXNRD3表达与患者结局显著相关的肿瘤的Kaplan-Meier曲线显示,TXNRD3低表达组患者的生存时间较长而高表达组患者的生存时间显著缩短(图3)。

DLBC:弥漫性大B细胞淋巴瘤;
MESO:间皮瘤;
PCPG:嗜铬细胞瘤和副神经节瘤;
SARC:肉瘤;
THYM:胸腺癌;
UVM:葡萄膜黑色素瘤
由于可能存在非因肿瘤死亡的因素,接着分析了在33种肿瘤中的TXNRD3表达与疾病特异性生存期的关系,结果显示TXNRD3可以显著影响KICH(HR=1.43,P=0.011)、PAAD(HR=1.17,P<0.001)、UCEC(HR=1.07,P=0.004)。进一步分析与无病间隔的关系,结果显示TXNRD3可以显著影响ESCA(HR=1.10,P=0.004)、PAAD(HR=1.57,P<0.001)。同时分析与预后无进展间隔的关系,结果显示TXNRD3可以显著影响ACC(HR=1.19,P=0.002)、KICH(HR=1.26,P=0.028)、PAAD(HR=1.17,P<0.001)、UCEC(HR=1.05,P=0.016)。同时,生存分析相关的Kaplan-Meier曲线显示TXNRD3低表达组的患者生存时间较长,通过这4种生存结果分析显示TXNRD3可以显著影响的共同肿瘤是PAAD。
TXNRD3与肿瘤免疫浸润的相关性R软件包“estimate”分析结果显示TXNRD3的表达与肿瘤的免疫浸润水平相关,特别是在KIRC、LUSC、PAAD中。在KIRC中,TXNRD3的表达水平与B细胞(R=0.236、P<0.001)、CD4+T细胞(R=0.162、P<0.001)、树突细胞(R=0.197、P<0.001)、巨噬细胞(R=0.313、P<0.001)、中性粒细胞(R=0.237、P<0.001)呈显著正相关。在LUSC中,TXNRD3的表达水平与树突细胞(R=-0.169、P<0.001)、中性粒细胞(R=-0.200、P<0.001)呈显著负相关。在PAAD中,TXNRD3表达与CD8+T细胞(R=0.578,P<0.001)、树突细胞(R=0.440,P<0.001)、巨噬细胞(R=0.511、P<0.001)、中性粒细胞(R=0.420,P<0.001)呈显著正相关(图4)。

DC:树突细胞;
Mø:巨噬细胞;
NE:中性粒细胞
TXNRD3的表达与免疫检查点基因和免疫新抗原的相关性提取常见的免疫检查点基因,分别计算其与TXNRD3的表达相关性,结果显示TXNRD3的表达与不同类型的肿瘤,如KIRC、AML和PAAD中免疫检查点基因的表达水平呈显著正相关(图5A)。TXNRD3表达与新抗原数量的关系显示在KIRP、LIHC、LGG中TXNRD3的表达与新抗原数量的关系有统计学意义,并且在KIRP(R=0.196,P=0.012)、LIHC(R=0.189,P=0.008)、LGG(R=0.170,P=0.017)中TXNRD3的表达与新抗原的数量呈正相关(图5B)。

*P<0.05,**P<0.01,***P<0.001
TXNRD3表达与微卫星不稳定性和肿瘤突变负荷的相关性Spearman相关分析结果显示TXNRD3在BRCA、DLBC、ESCA、HNSC、AML、PAAD、SARC、STAD、THCA中的表达与TMB的关系有统计学意义,TXNRD3表达在HNSC、AML、STAD中与TMB呈正相关,在BRCA、DLBC、ESCA、SARC、THCA中与TMB呈负相关(图6A)。在KIRC、STAD、TGCT、THCA、UCEC中TXNRD3的表达与MSI的关系有统计学意义,在KIRC、STAD、TGCT、UCEC中TXNRD3表达与MSI呈正相关,在THCA中呈负相关(图6B)。

图6 肿瘤组织中TXNRD3表达与肿瘤突变负荷(A)、微卫星不稳定性(B)的相关性
TXNRD3对DNA错配修复基因在肿瘤中表达的影响利用TCGA的表达谱数据评估,结果显示除CHOL、DLBC、MESO和UCS外,在其他肿瘤组织中DNA错配修复基因(MLH1、MSH2、MSH6、PMS2、EPCAM)均与TXNRD3表达呈正相关(图7)。

*P<0.05,**P<0.01,***P<0.001
TXNRD3基因富集分析结果通过富集分析列出了在KEGG与HALLMARK基因集中与TXNRD3差异表达结果相关性排名的前3位,其中泛素介导的蛋白水解和血红素代谢是相关性最强的信号通路。此外,在KEGG中,TXNRD3差异表达在肾细胞癌、急性髓性白血病、胰岛素信号通路、神经营养因子信号通路、结直肠癌、ErbB转导通路、RIG-1信号通路等富集;
在HALLMARK中,TXNRD3差异表达在PI3K-Akt-mTOR信号通路、蛋白质分泌、胆汁酸代谢、过氧化物酶、脂肪酸代谢、Notch信号通路等富集(图8)。

ES:富集分数;
NES:标准化的富集分数;
FDR:错误发现率
恶性肿瘤是一类严重影响人类健康的重要慢性病,它的发生是多种因素综合作用的结果,需要多个基因参与调控,多个步骤完成,肿瘤的生物学基础是基因突变、基因表达失常,从而形成功能异常、无限增殖、恶性代谢的肿瘤细胞。从基因出发,探索其与肿瘤发生、发展之间的关系,并对肿瘤的免疫治疗和预后预测的靶点[16-17]进行深入研究是研究的重点。
研究显示TXNRD3在肿瘤中有重要的作用,TXNRD3高表达组的肿瘤侵袭力强,增殖速度快,凋亡率较低,并且转移力较强[18]。一方面,肿瘤增殖的必要环节是正常细胞周期的失调,TXNRD3可以通过调控硫氧还蛋白的含量以及活化程度,使硫氧还蛋白与还原核氧化还原因子相互作用从而影响肿瘤细胞转录激活因子的活性,间接引起细胞周期失调,肿瘤细胞快速增殖[19];
另一方面,TXNRD3属于抗氧化系统蛋白,TXNRD3可通过调控硫氧还蛋白,使活性氧活性及水平降低而防御氧化应激,维持体内氧化还原平衡而抑制凋亡,但正常细胞发展为肿瘤细胞后,则会抑制肿瘤细胞凋亡,促进肿瘤细胞增殖,引起肿瘤预后不良[20]。肿瘤的生长还需要很多新生的血管进行血液供应,而敲除细胞及组织中的TXNRD3可使血管生成受到抑制,从而抑制肿瘤的生长[21-22]。有研究者用TXNRD3的反义RNA抑制TXNRD3生长,结果显示肿瘤的生长与扩散量急剧降低,与此同时,肿瘤相关蛋白的mRNA转录水平也显著下降[23]。硫氧还蛋白系统[24]是维持生物体氧化还原平衡和基于氧化还原信号通路调节的关键抗氧化系统,在抗肿瘤药物研究方面,TXNRD3抑制剂会严重影响整个细胞的硫氧还蛋白系统的功能,引发氧化应激介导的肿瘤细胞凋亡,起到抗癌的效果,表明TXNRD3抑制剂可作为潜在的肿瘤治疗剂[25-26]。
目前分子机制研究仍以单基因单病种研究为主,在识别肿瘤早期生物标志物方面有很大局限性,因此,本研究进行TXNRD3的全面泛癌分析。多个数据库的差异分析结果表明,TXNRD3在肿瘤和正常组织中均有表达,其中在15个肿瘤组织中的表达水平明显高于正常组织,提示TXNRD3可能与肿瘤发生、发展相关。总生存期、疾病特异性生存期、无病间隔、无进展间隔4种生存分析结果比较显示,TXNRD3与PAAD患者预后不良密切相关,提示TXNRD3可能是PAAD中潜在的预后指标分子。此外,本研究显示在某些肿瘤中TXNRD3的表达水平与肿瘤免疫浸润相关,表明在这些肿瘤中TXNRD3可能是潜在的免疫调节生物标志。同时,研究显示与免疫新抗原、免疫检查点基因表达相关,提示TXNRD3可能通过调节免疫检查点基因的表达水平而在调节肿瘤免疫模式中发挥作用,TXNRD3影响TMB与MSI,影响结果因肿瘤的类型不同而异。TXNRD3与DNA错配修复基因的关系提示TXNRD3可通过上调相关DNA错配修复基因维持肿瘤细胞的活力。最后,通过基因集富集分析显示TXNRD3广泛参与肿瘤代谢和肿瘤免疫的信号通路的调控,值得注意的是,泛素介导的蛋白水解和血红素代谢被描述为相关性最强的信号通路,这些信号通路的最高富集分数都落在TXNRD3的高表达区域,表明高表达的TXNRD3积极参与这些信号通路的调节,而TXNRD3可能在促进泛素介导的蛋白水解以及通过驱动血红素代谢等生物信号转导途径的上调在促进肿瘤细胞增殖方面发挥作用。
综上,TXNRD3对多种人类肿瘤的生存预后可产生重要影响,本研究揭示了TXNRD3在肿瘤靶向治疗中的潜力,可能是潜在的免疫调节因子,且提示TXNRD3在大多数肿瘤中是一种很有效的肿瘤预测生物标志物,值得深入研究探讨。然而,TXNRD3如何影响泛素介导的蛋白水解、血红素代谢等生物信号转导途径以及TXNRD3在每种肿瘤中的具体作用机制,仍然是值得思考的问题。
猜你喜欢抗原通路蛋白氧化槐定碱体内体外通过AKT/mTOR通路调控自噬抑制HBV诱发肝纤维化世界科学技术-中医药现代化(2022年2期)2022-05-25小檗碱治疗非酒精性脂肪肝病相关通路的研究进展现代临床医学(2021年4期)2021-07-31负载抗原DC联合CIK对肝癌免疫微环境的影响昆明医科大学学报(2021年1期)2021-02-075 种大肠杆菌O 抗原定型血清的制备中国兽医杂志(2019年5期)2019-09-18ITSN1蛋白磷酸化的研究进展天津医科大学学报(2019年6期)2019-08-13关于血型问题的释疑生物学教学(2018年10期)2018-11-29猪胎盘蛋白的分离鉴定中成药(2017年8期)2017-11-22苦参碱抑制RPMI8226细胞增殖及对Notch通路的影响中成药(2017年10期)2017-11-16SAK -HV 蛋白通过上调 ABCG5/ABCG8的表达降低胆固醇的吸收医学研究杂志(2015年7期)2015-06-22通路快建林翰:对重模式应有再认识创业家(2015年1期)2015-02-27