窦涵钰,崔白苹,丁小雷
(上海大学医学院,上海 200444)
皮肤是人体最大的器官,总面积约1.5∼2.0 m2,占体重的5%∼15%,可保护组织器官免受理化伤害、病原体的入侵,以及防止水分过度丢失[1].人的皮肤主要由表皮、真皮、皮下组织三部分组成.毛发和腺体等附属物来源于表皮,根植于真皮层.成纤维细胞、巨噬细胞和肥大细胞是真皮组织的主要组成细胞.真皮以下是高度血管化和神经支配的皮下脂肪组织.
皮肤作为人体的第一道防线,常因物理性、机械性、生物性和化学性等因素而发生各种损伤(统称为创面).创面愈合需要多种细胞、细胞因子和细胞外基质(extracellular matrix,ECM)时空协同完成.当皮肤受损时,伤口附近的成纤维细胞被激活并合成分泌大量的胶原纤维,同时包括巨噬细胞在内的炎症细胞分泌炎症因子和生长因子协同启动修复反应.当损伤较小时,细胞外基质在修复中短暂沉积,创面可以快速有效愈合;然而,如果损伤比较严重或者反复受损,细胞外基质沉积,纤维结缔组织大量增生,就会形成坚硬的、形状不规则的疤痕.病理性瘢痕可以分为增生性瘢痕和瘢痕疙瘩,前者在原始伤口边界内发展,易随时间消退,而后者则会无限制生长形成瘢痕疙瘩[2].在发达国家,每年大约有一亿人患有与疤痕有关的疾病,仅在美国抗疤痕药物的市场就高达120亿美元,已成为世界公共卫生和经济的重大威胁[3].
创面愈合是创伤后维持皮肤完整性的重要生理过程,正常的创面愈合是一个连续的过程,主要分为3个连续且重叠的阶段:止血/炎症期、肉芽组织增殖期和重塑期[4],在创面修复的任何阶段出现异常都可能会导致瘢痕的产生.止血阶段的血小板功能紊乱会增加纤维粘连蛋白和肉芽组织产生,引起伤口组织的过度增生,导致瘢痕形成.伤口局部的炎症增强,转化生长因子-β(transforming growth factor beta,TGF-β)浓度增加会导致病理性瘢痕的产生.成纤维细胞和巨噬细胞对胶原沉积和ECM的重塑也会导致瘢痕形成[5].近期研究表明,成纤维细胞和巨噬细胞之间可以通过TGF-β相互作用,因此纤维化程度可能是由成纤维细胞和巨噬细胞的旁分泌相互作用介导的纤维化与溶解活性的平衡决定的[6].
创面愈合的结果分为完全组织再生和纤维化修复(形成瘢痕).在早期哺乳动物胚胎中,背部皮肤可以实现完全再生,但在人类妊娠晚期之前的某个阶段丧失了这一再生功能[7].与正常皮肤相比,瘢痕没有毛囊、腺体等真皮附属物,且伴有过量的胶原沉积,强度小于正常皮肤[8].瘢痕的细胞外基质的重组有别于正常皮肤的多孔晶格组织——类似于“篮子”的编织结构,而成纤维细胞则是合成和重组细胞外基质导致瘢痕增生的关键性细胞.
2.1 成纤维细胞的不同亚型及其在瘢痕形成中的作用
不同成纤维细胞谱系在皮肤发育、体内平衡和对急慢性炎症的反应方面均不同.不同的成纤维细胞谱系决定了皮肤发育和修复中的真皮结构.为了全面理解成纤维细胞在创面愈合和瘢痕形成中的作用,需要了解不同的成纤维细胞类型及功能.
2.1.1 根据功能分类
在小鼠背部皮肤中存在En1谱系阳性成纤维细胞(Engrailed-1 positive fibroblasts,EPFs)和En1谱系阴性成纤维细胞(Engrailed-1 negative fibroblasts,ENFs)[9].EPFs是造成皮肤疤痕和黑色素瘤生成的主导者,而ENFs不会导致纤维化瘢痕.在胚胎发育阶段,ENFs占真皮成纤维细胞的95.5%,EPFs占比不到1%.在皮肤发育过程中,从ENFs主导逐渐转变为EPFs主导,皮肤也从组织再生转变为瘢痕形成.除去EPFs可以减少伤口中结缔组织沉积,减少疤痕形成,并减少黑色素瘤生长.近期研究发现,选择性抑制成纤维细胞Yes相关蛋白(Yes-associated protein,YAP)信号可以阻止En1的激活,促进ENFs介导的伤口修复,减少纤维化和疤痕生成[10-12].与背部皮肤类似,在小鼠口腔真皮中存在Wnt1谱系阳性成纤维细胞(Wnt1 positive fibroblasts,WPFs)和Wnt1谱系阴性成纤维细胞(Wnt1 negative fibroblasts,WNFs),其中WPFs引起ECM沉积.
通过时空单细胞测序分析人的不同功能真皮成纤维细胞亚群,发现真皮成纤维细胞至少可以分为4类:位于上层真皮的lin−CD90+CD39+CD26−成纤维细胞,并表达COL6A5;位于下层真皮的lin−CD90+CD36+成纤维细胞,与脂肪前体细胞共表达CD90和CD36标记物;位于整个网状真皮的lin−CD90+CD39−RGS5+和lin−CD90+CD39+CD26+成纤维细胞[13].通过单细胞分析特性皮炎患者的皮肤发现,COL6A5+COL18A1+成纤维细胞亚群与T细胞和炎性分枝状细胞相互作用参与皮肤炎症的进程[14].
2.1.2 根据空间位置分类
真皮成纤维细胞亚群根据不同的空间位置分为上层乳头真皮(papillary dermis,PD)成纤维细胞和下层网状真皮(reticulate dermis,RD)成纤维细胞,它们有不同的形态特征及特性[15].乳头状成纤维细胞通常是细长的纺锤形状,网状成纤维细胞则是方正拉伸的形态[16].已有研究发现,乳头状成纤维细胞是形成毛囊所必需的,网状成纤维细胞会在伤口处表达α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA),产生ECM,最终导致纤维化发生[17].PD和RD受不同信号调控,Wnt/β-连环蛋白和Sonic hedgehog(Shh)可以刺激PD增殖和ECM的重塑,而RD对表皮转化生长因子(TGF-β)信号产生反应[16].
2.1.3 根据表面标记分类
为了确定不同成纤维细胞亚群的功能和基因表达上的差异,需要不同的分子标记.在人和小鼠的真皮中,CD39在乳头状真皮中上调,CD36在下层网状真皮组织中上调.CD90+CD39+成纤维细胞亚群富集在真皮上层,参与上皮化;CD90+CD36+成纤维细胞亚群则富集在真皮下层,更多参与疤痕形成.已有研究者通过单细胞RNA测序技术来研究皮肤成纤维细胞的异质性,根据表达标记物将人真皮成纤维细胞分为分泌乳头状、分泌网状、间充质和促炎症4个亚群.在瘢痕疙瘩中,间充质成纤维细胞亚群的百分比显著增加.相关功能研究表明,间充质成纤维细胞是瘢痕疙瘩胶原过度表达的关键.在纤维性皮肤病硬皮病中也发现间充质成纤维细胞亚群增加,这表明间充质成纤维细胞参与皮肤纤维化[10].
2.2 成纤维细胞粘附在瘢痕形成中的作用
2.2.1 肌成纤维细胞与ECM粘附
转化生长因子(TGF-β)是激活成纤维细胞最常见的细胞因子,在创面愈合的炎症阶段,炎症细胞分泌TGF-β,诱导成纤维细胞向肌成纤维细胞转化,并合成大量ECM成分,如Ⅰ型和Ⅲ型胶原、纤连蛋白、层粘连蛋白和其他基底膜蛋白.目前普遍认为,瘢痕形成主要是由肌成纤维细胞分化介导的,肌成纤维细胞持续激活会导致组织挛缩变形产生大的疤痕[18].肌成纤维细胞的收缩力主要是依赖于肌成纤维细胞与血管和过度沉积的ECM粘附形成的肉芽组织[19],成纤维细胞对肉芽组织的牵拉导致组织挛缩[20-21].
成纤维细胞在微环境的影响下,可以将机械信号转为生物信号来调节纤维化反应[22].已有研究表明,成纤维细胞可以通过细胞表面的整合素受体与基质蛋白结合,来调节细胞外基质的重塑.整合素介导的成纤维细胞与基质的粘附通过整合素-FAK-Rho GTP酶途径完成[23].整合素聚集并激活粘着斑激酶(focal adhesion kinase,FAK),FAK可以介导成纤维细胞迁移,导致瘢痕增加[24](见图1).

图1 成纤维细胞介导瘢痕形成过程Fig.1 Process of fibroblast mediated scar formation
2.2.2 成纤维细胞间粘附
除了细胞与基质之间粘附,成纤维细胞之间的粘附对于伤口收缩和瘢痕形成也十分重要.皮下筋膜由疏松的网状结缔组织构成,在皮肤和体内组织器官之间形成一层较薄的无摩擦界面.已有研究发现,皮肤损伤会引起筋膜成纤维细胞集体迁移,使皮肤逐渐收缩最终形成疤痕[25],迁移的成纤维细胞是在胚胎早期表达Engrailed-1的EPFs.EPFs聚集需要一种粘附分子,细胞粘附又是一个依赖钙的过程.钙粘蛋白是跨膜蛋白,可以通过粘附连接将细胞结合起来[26].当皮肤受损时,筋膜EPFs会上调N-钙粘蛋白,促使筋膜EPFs向伤口中心集体迁移并聚集.大量成纤维细胞产生紧密的胶原纤维,重塑结缔组织,最终形成疤痕,使组织柔韧性降低.减少N-钙粘蛋白表达,可减小疤痕面积.
在筋膜EPFs中显著高表达连接蛋白Cx43,Cx43协调EPFs集体迁移和筋膜基质移位进入伤口,从而介导疤痕形成[27].Cx43可能是N-钙粘蛋白上游的转录因子,敲除Cx43会降低N-钙粘蛋白水平[28].已有实验结果证明,TGF-β通过Smad途径诱导Cx43的表达,通过Erk/MMP-1/胶原Ⅲ途径促进瘢痕形成[29].
巨噬细胞由骨髓产生,在外周血中循环或迁移至几乎每一个组织,是人类先天免疫和后天免疫的重要效应细胞[30].巨噬细胞在伤口修复中发挥重要的作用,如清除死亡细胞、碎片和病原体,通过细胞外基质沉积再血管化和伤口再上皮化.巨噬细胞在创面愈合中为伤口提供关键的信号分子,巨噬细胞功能障碍会使Ⅰ型和Ⅲ型胶原沉积增加,肌成纤维细胞活化增殖,进而影响正常的再生过程,甚至会促进纤维化的发展[31].
3.1 巨噬细胞谱系和表型可塑性
巨噬细胞分为组织常驻巨噬细胞和单核细胞衍生的巨噬细胞[32].巨噬细胞将抗原递呈到免疫活性T细胞,启动适应性免疫反应[33].巨噬细胞是组织修复各个阶段中最丰富的炎症细胞之一[34],巨噬细胞被招募到损伤部位后开始清除细胞碎片和坏死组织,还可以分泌蛋白酶和促炎介质防止病原体的入侵.
根据细胞的表面标记,巨噬细胞大致可以分为M1型和M2型.M1巨噬细胞可以被干扰素-γ(interferon-γ,IFN-γ)和肿瘤坏死因子(tumor necrosis factor,TNF)激活,产生大量的促炎细胞因子和趋化因子,如白细胞介素-6(interleukin-6,IL-6),TNF-α和其他伤口愈合初始阶段的介质,因此M1巨噬细胞被称为促炎巨噬细胞.M1巨噬细胞具有很强的吞噬能力,可以吞噬凋亡的中性粒细胞,清除伤口中的病原体.而选择性激活的M2型巨噬细胞被IL-4、IL-13激活,分泌抗炎效应物,如IL-10、转化生长因子β1(TGF-β)等,因此M2巨噬细胞被称为抗炎巨噬细胞.M2巨噬细胞可以调节炎症反应,参与后期伤口修复过程[35-36].
巨噬细胞持续被促炎因子激活和M2型巨噬细胞功能受损出现在各种慢性炎症环境中,包括慢性伤口[37]、肺部炎症[38]、动脉粥样硬化[39]和胰岛素抵抗[40-41].M2型巨噬细胞持续激活则会导致组织纤维化和瘢痕形成[42].另有多项研究表明,伤口局部环境可以诱导巨噬细胞从M1表型转变为M2表型,这可以让巨噬细胞成为抗瘢痕的一个治疗靶点[43].
3.2 巨噬细胞对创面愈合与瘢痕形成的调控作用
除了成纤维细胞,巨噬细胞也在创面修复和疤痕形成中起重要作用.在创口早期主要分布的是M1型巨噬细胞,在创伤后7∼14 d达峰,而M2型巨噬细胞主要分布在晚期伤口和瘢痕的增生期,在创伤后14∼28 d达峰[44].巨噬细胞介导成纤维细胞增殖、肌成纤维细胞分化和胶原沉积.巨噬细胞的数量和表型变化会影响创面愈合过程并且决定疤痕的形成.当巨噬细胞总数减少,表型由M1转为M2,说明伤口从以再上皮化和肉芽组织发育为主的修复阶段进入稳定阶段[45],若创伤持续存在,M1型巨噬细胞在较长时间内不向M2型巨噬细胞转变,就会导致创面愈合时间延长(见图2).
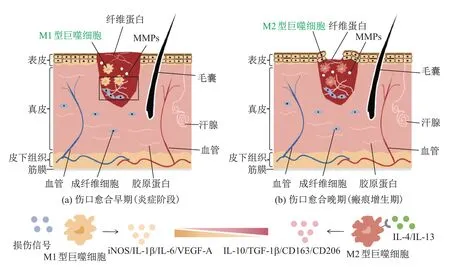
图2 巨噬细胞介导瘢痕形成过程Fig.2 Process of macrophage mediated scar formation
巨噬细胞通过肌成纤维细胞分化影响胶原合成,或通过分泌基质金属蛋白酶(matrix metalloproteinases,MMPs)直接调控ECM成分[36].MMPs可以降解基质中各种类型的胶原蛋白,维持正常真皮结缔组织量的相对稳定,在伤口修复过程中还有清除坏死组织、促进细胞迁移和组织重塑的作用.巨噬细胞可以通过向肌成纤维细胞分化参与瘢痕的形成[40].巨噬细胞可以分泌MMP-10来应对皮肤损伤[39],在MMP-10-/-小鼠受损皮肤中,巨噬细胞数量和移动情况正常,但瘢痕较重,说明巨噬细胞分泌的MMPs在皮肤损伤修复过程中调节了组织重塑并减轻了瘢痕的形成[40].
在创伤早期阶段,巨噬细胞在IFN-γ和TNF-α的作用下分化为M1型,在瘢痕愈合晚期和增生性瘢痕形成中会分离出较多的与M2型巨噬细胞相关的TNF-β,使M2型巨噬细胞在创面愈合过程中增加,在重塑阶段达到峰值,在增生性瘢痕形成过程中减少.若创伤持续存在,M2型巨噬细胞参与促进纤维化形成并分泌TNF-β,间接促进ECM生成和成纤维细胞向肌成纤维细胞分化[46].巨噬细胞和成纤维细胞本身来源的TGF-β可以作为纤维化中巨噬细胞与成纤维细胞相互作用的信号,促进成纤维细胞活化.M1型巨噬细胞可以产生IL-6活化成纤维细胞,活化的M2型巨噬细胞可以产生驱动成纤维细胞增殖的因子,如血小板衍生生长因子(platelet derived growth factor,PDGF).巨噬细胞还可以分泌IL-10抑制肌成纤维细胞分泌α-SMA和Ⅰ型胶原蛋白(见图3).成纤维细胞和巨噬细胞可以通过参与ECM的调控实现相互作用,成纤维细胞可以沉积和组织ECM,而巨噬细胞则可以降解和修饰ECM[6].

图3 瘢痕形成过程中成纤维细胞与巨噬细胞的相互作用Fig.3 Interaction between fibroblasts and macrophages during scar formation
3.3 以巨噬细胞为靶点治疗增生性瘢痕
在增生性瘢痕性动物模型中,巨噬细胞的全身性耗竭有效地抑制了创面愈合亚急性期的增生性瘢痕形成,并下调M1相关细胞因子(TNF-α,IL-1β和IL-6)和M2相关细胞因子(TGF-β1,IL-10和IL-1α)[47].在巨噬细胞选择性耗竭的转基因小鼠模型中,发现巨噬细胞的消耗可显著减少炎症期血管化肉芽组织的形成和上皮化,最终减少肉芽组织和瘢痕形成[48].相反,也有研究表明,在修复过程之前和整个修复过程中,使用白喉毒素驱动溶菌酶消耗巨噬细胞的策略会导致创面愈合受损[22].如果没有巨噬细胞,伤口就无法清除中性粒细胞,同时就没有高水平的促炎细胞因子使得转化生长因子β1表达降低[49],从而减少肌成纤维细胞分化导致的伤口收缩减弱,以及血管内皮生长因子(vascular endothelial growth factor,VEGF)表达滞后导致的血管生成减少[49].近期研究表明,肥胖会上调S100A9激活核因子κB(nuclear factor kappa-B,NF-κB),进而抑制巨噬细胞向M2型分化,导致皮肤损伤不能快速修复,形成肥胖相关的皮肤炎症.若抑制S100A9则可治疗肥胖相关皮肤炎症,促进创面愈合[50].
综上,M1巨噬细胞的存在时间延长和/或表达增加,M2巨噬细胞数量减少和/或M2活化增加,都可以改变伤口炎症的微妙平衡,从而显著影响修复过程.从M1表型到M2表型转换的任何失败都会导致炎症增加和大量TNF-α的分泌,从而抑制慢性伤口的愈合.
瘢痕形成和完美再生是创面组织修复过程中两个完全相反的结果.在哺乳动物胎儿早期存在无瘢痕愈合和再生,随后在胎儿晚期和新生儿早期之间消失.这可能是由于胎儿的免疫反应较弱和En1谱系阴性成纤维细胞介导皮肤修复,从而产生较低水平的免疫细胞而达到完全组织再生性修复.然而,一些低等生物如蝾螈却一直具有完美再生的能力,为什么哺乳动物在进化过程中失去了这种能力?可能是为了减少病原体感染而进化的超越正常皮肤生长速度的快速修复能力,但是这种能力却留下了不可避免的问题——瘢痕.因为瘢痕的形成是一个十分复杂的过程,受不同类型的细胞、细胞因子、信号通路、基因调控等多种因素共同作用,目前临床上尚缺乏治疗瘢痕的特效药.
成纤维细胞和巨噬细胞一直被认为是瘢痕形成的主要参与细胞,通过研究成纤维细胞的不同亚群和不同修复阶段巨噬细胞类型,以及成纤维细胞和巨噬细胞在创面修复过程中的相互作用,可以使研究者更深入了解创面瘢痕形成的机制.如果可以抑制成纤维细胞激活和促进M1型巨噬细胞向M2型巨噬细胞转化,就可以减少瘢痕形成,促进慢性炎性创面愈合.斯坦福大学的相关研究发现,阻断Engrailed-1激活和抑制En1阳性成纤维细胞的YAP信号,使得En1阴性成纤维细胞可促进皮肤再生,并完全恢复正常的毛囊、腺体、基质超微结构和机械强度[11-12],在不久的将来有望通过药物实现无瘢痕修复.
猜你喜欢真皮疤痕纤维细胞Tiger17促进口腔黏膜成纤维细胞的增殖和迁移昆明医科大学学报(2021年8期)2021-08-13滇南小耳猪胆道成纤维细胞的培养鉴定云南医药(2021年3期)2021-07-21无惧疤痕意林·全彩Color(2019年8期)2019-09-23最美的疤痕小学生作文(低年级适用)(2017年4期)2017-07-07每一道疤痕都有一个故事学生天地(2017年10期)2017-05-17烧伤变形脱细胞真皮基质用于烧伤创面修复的可行性研究西南国防医药(2016年7期)2016-12-01疤痕唐山文学(2016年11期)2016-03-20胃癌组织中成纤维细胞生长因子19和成纤维细胞生长因子受体4的表达及临床意义中国现代医学杂志(2015年26期)2015-12-23急诊使用人工真皮覆盖修复指(趾)末节小面积皮肤软组织缺损实用手外科杂志(2015年3期)2015-08-27生态环保让真皮标志产品更美丽西部皮革(2015年3期)2015-04-16