陈 威,马沛明,张俊芳,杨 英,周连凤,赵先富
(1:水利部中国科学院水工程生态研究所, 水利部水工程生态效应与生态修复重点实验室, 武汉430079) (2:长江流域水生态监测中心,武汉 430079)
作为水生态系统中有机化合物的重要分解者之一,水体细菌在地球物质化学循环中起到非常重要的作用[1]。水体细菌在直接或间接地参与大部分物质和能量的循环过程中,其丰度和群落结构对其功能发挥起到决定性作用。目前,在水生态监测工作中,生物监测对象主要为浮游动植物、底栖动物和着生藻类,针对微生物(细菌、真菌等)的运用在国外有一些报道[2],但是在国内还较少[3]。水环境监测和评价的内容是监测物种或群落对环境变化的真实响应,并不包含空间结构等随机过程的影响。然而,水体细菌的群落结构和动态变化受多方面因素影响[4],因此,研究水体细菌的空间分布规律及群落构建驱动机制,摸清环境和空间对其群落组成影响的相对贡献,分离不同作用主导下的类群,准确筛选环境指示性物种或类群,对广泛地将水体细菌运用于水生态监测具有重要意义。
生态学家们普遍认为群落的分布机制受随机性过程和确定性过程两方面的共同影响,其影响的主次依据不同的生物类群或其所处的不同生态系统而定[5]。随机性过程主要与空间因子相关,表征群落扩散等作用方式;
确定性过程主要与环境因子相关,如水体理化和生境特征指标[6],表征环境对特定物种的选择作用。目前研究多关注细菌群落动态变化[7-8]或其环境影响因子[9-11],如湖北梁子湖和后官湖浮游细菌研究表明,总氮、pH和总磷是其群落结构的主要影响因子[8],忽视了空间因素对其分布格局和群落构建机制的作用。然而研究表明,随水流的扩散作用是浮游生物类群群落构建的重要影响因素[12]。
洞庭湖位于长江中游,是我国第二大淡水湖,由于人类活动的影响,已经明显被分为东、西、南3 个湖区[13];
鄱阳湖位于长江中下游,是我国第一大淡水湖泊,年内水位落差巨大(变幅为 9.59~15.36 m)[14],两者均为过水型浅水湖泊。与静水型湖泊相比,过水型湖泊受单向水体流动影响,水体细菌的分布受水体扩散影响较为明显,一定程度上可以减小环境对物种的选择作用。因此,同期联合调查洞庭湖和鄱阳湖,比较两湖在水体细菌组成和生境空间差异,全面了解湖泊生态系统中水体细菌空间分布特征和驱动机制,对于更好地保护和修复湖泊生态环境具有深远的意义[10]。
本研究拟从两湖水体细菌群落组成、理化指标和调查样点空间关系的基础上,探索过水型湖泊生态系统中水体细菌的空间分布特征及其影响因素,揭示水体细菌群落构建内在机理,为了解两湖水生态系统的生物群落构建及其健康管理提供理论依据。
1.1 样品采集与处理
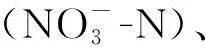
有研究认为过水型湖泊存在对流性强的特点,其富营养化评估应与河流一致,在流速不均匀的大型湖泊,还应分区域进行研究[15]。根据洞庭湖和鄱阳湖过水型湖泊的特定,按其水流方向,将采样点各分为上游(DU或PU)、中游(DM或PM)、下游(DD或PD)3组,其中洞庭湖分为DU(D01~12)、DM(D13~20,D28~30)、DD(D21~27,D31~33),鄱阳湖分为PU(P06~08,P10~12)、PM(P09,P13~18)、PD(P01~05,P19~24),如图1所示。

图1 洞庭湖(a)与鄱阳湖(b)采样点分布Fig.1 Distribution of sampling sites in Lake Dongting (a) and Lake Poyang (b)
1.2 细菌DNA的提取和16S rRNA高通量测序
两湖水体微生物样品全DNA的提取采用试剂盒(Axygen)的方法,通过1%凝胶电泳检测提取效果,并使用Nanodrop(Nanodrop,美国)测试其浓度,确保提取到足够浓度的DNA。每个样点分3个重复样提取完后充分混合,后采用Hiseq 250平台(深圳瑞奥康晨生物科技有限公司)进行高通量测序。测序引物选用16S rRNA通用引物341F:5′-CCTAYGGGRBGCASCAG-3′和806R:5′-GGACTACNNGGGTATCTAAT-3′,PCR扩增区域为水体细菌16S rRNA基因V3-V4高变片段。
1.3 数据分析
对原始数据进行拼接、过滤等处理后得到有效OTUs(Operational taxonomic units)序列。将具有97%以上相似性的序列归为一类,经与Silva数据库(V13.2)比对注释后得到各位点的细菌种类组成和丰度分布。通过对洞庭湖和鄱阳湖共57个样点的水体细菌16s r RNA V3~V4区进行高通量测序检测分析,经注释后检测出OTU 序列27134~70515条,归一化后为27134条,作进一步分析用。
本研究的环境数据可视化由R语言ggplot2包进行,均值差异性检验采用PERMANOVA方差检验;
物种组成和多元分析在线(https://www.bioincloud.tech)完成;
方差分解分析(Variation partitioning analysis,VPA)由vegan包进行:首先,通过前向选择(forward selection,adespatial包),筛选出对细菌群落影响显著的环境因子;
然后,基于邻体矩阵主坐标分析(principal coordinates of neighbor matrices,PCNM)计算采样点之间的空间关系,同样通过前向选择筛选细菌群落潜在的空间影响因子;
最后,通过vegan包的varpart函数对已筛选的环境因子和空间因子进行方差分解分析;
零模型分析通过picante包进行:通过计算β最接近分类指数(βNTI)和Raup-Crick指数(RC)对水体细菌群落的群落构建过程进行了分析。βNTI<-2的为同质选择,βNTI>2则为异质选择,|βNTI|≤2的部分均为随机性过程,并依据RC的大小进行分类:其中RC<0.95表示同质扩散,RC>0.95表示扩散限制,|RC|≤0.95表示漂变。
2.1 两湖水质特征


图2 洞庭湖和鄱阳湖环境因子主成分分析Fig.2 PCA of environmental factors in Lake Dongting and Lake Poyang

图3 洞庭湖和鄱阳湖环境因子Fig.3 Environmental factors in Lake Dongting and Lake Poyang
2.2 两湖水体细菌群落组成
两湖水体细菌一共检测出20门(平均丰度低于0.1%的门归为“其他”),其中洞庭湖优势的门类有放线菌门(Acitinobacteria)、蓝细菌门(Cyanobacteria)和变形菌门(Proteobacteria),D10~12位点变形菌门相对丰度较高,而D01、D18、D31~33位点拟杆菌门(Bacteroidetes) 相对丰度较高;
鄱阳湖优势的门类与洞庭湖相似,有放线菌门、蓝细菌门和变形菌门,其中P05号与P04位点距离近,但是其群落组成差别较大,P05位点壁厚菌门(Firmicutes)相对丰度高于其他位点;
在门水平上,洞庭湖和鄱阳湖组不同位点之间差异较小,但是两湖之间水体细菌组成存在一定差异(图4)。

图4 洞庭湖(a)和鄱阳湖(b)水体细菌门水平物种组成Fig.4 Bacteria community composition in Lake Dongting (a) and Lake Poyang (b)
通过比较各组水体细菌组成在门水平上的相对丰度,可知洞庭湖上游组(DU)中放线菌门相对丰度较其他两组高,而蓝细菌门相对丰度较低;
鄱阳湖各组之间,水体细菌优势门相对丰度差异较小。水体细菌组成中,蓝细菌门的种类一直被广泛关注,主要是因为蓝细菌在富营养化水体中极易形成水华,危害水生态健康[13]。从两湖内部样点群落组成比较来看,洞庭湖各样点的蓝细菌门相对丰度分布不均匀,各样点平均相对丰度为18.76%,分布范围为0.93%~51.31%,最高值出现在D29位点。具体分组上,在下游组(DD)样点中相对丰度较低,平均为12.25%,上游组(DU)次之,平均为17.28%,在中游组(DM)最高,平均为32.84%;
在鄱阳湖中,蓝细菌门在各样点的相对丰度分布较为均匀,离长江入口(湖口)距离较近的下游组(PD)样点平均丰度最低,为16.02%,中游组(PM)样点最高,为24.29%,上游组(PU)样点处于中间水平,为20.81%,全湖各样点均值为19.63%(图5)。

图5 洞庭湖和鄱阳湖各组水体细菌门水平物种组成Fig.5 Bacteria community composition of different groups in Lake Dongting and Lake Poyang
2.3 两湖水体细菌的空间分布格局及影响因素


图6 洞庭湖(DU、DM和DD)和鄱阳湖(PU、PM和PD)水体细菌群落组成的冗余分析Fig.6 Similarity analysis of bacterioplankton community composition in Lake Dongting (DU, DM and DD) and Lake Poyang (PU, PM and PD)


图7 洞庭湖(a)和鄱阳湖(b)水体细菌中蓝细菌和其他类群与环境因子之间的相关性Fig.7 The relationship (Mantel rest) between cyanobacteria and other bacterioplankton with environmental factors in Lake Dongting (a) and Lake Poyang (b)
2.4 两湖水体细菌的群落构建机制
采用方差分解的方法对环境因子和空间因子进行分析,解析两者对两湖水体细菌群落结构形成的贡献差异,推断不同湖泊水体细菌群落的构建机制[14]。结果表明:洞庭湖水体细菌群落影响因素中纯环境因子解释度为2.0%,纯空间因子为15.0%,两者共同解释度为27.0%;
而鄱阳湖水体细菌群落影响因素中纯环境因子解释度为19.0%,空间因子为13.0%,两者共同解释度为6.0%(图8)。零模型分析结果表明,随机性过程是洞庭湖和鄱阳湖水体细菌分布的主要作用方式,分别占58.5%和79.7%,主要由同质扩散和漂变组成,扩散限制均为0;
在两湖中,确定性过程的作用占比低于随机性过程,分别为41.5%和20.3%,由同质选择和异质选择组成,且占比差异较大,前者分别为36.8%和15.6%,而后者均低于5%,占比较小(图8)。

图8 洞庭湖和鄱阳湖水体细菌群落构建方差分解和零模型分析Fig.8 Analysis of variation partitioning and null model analysis for the assembly mechanisms of planktonic bacterial communities in Lake Dongting and Lake Poyang
本研究以水体细菌作为研究对象,同期调查洞庭湖和鄱阳湖,获取两湖不同区域水体细菌组成和环境因子及空间因子数据,运用多元分析的方法探讨水环境的空间异质性、物种组成差异及影响因子,采用方差分解和零模型的方法分析水体细菌群落构建的机制,加强了对过水型湖泊的生态过程的理解,同时也为湖泊生态健康的监测和评价拓宽领域。
3.1 两湖水环境异质性
在本次调查期间,洞庭湖与鄱阳湖在水环境条件上差异显著,且鄱阳湖内部各样点之间空间异质性较洞庭湖更高。研究表明,高坝水库中调水口的浮游植物丰度较其他位置低,且与其调水口流速和调水量呈显著负相关[16],李哲等的研究同样表明,三峡水库季节性的调蓄变化导致的生境条件变化是藻类生物多样性改变的重要原因[17]。在本研究调查期间,洞庭湖和鄱阳湖受上游河流来水和长江干流水位变化的双重影响,通过水位波动对湖泊水生境和营养状态产生一定影响[18]。通过比较两湖水环境参数,洞庭湖水体营养物质浓度较高、Chl.a浓度却较低,可以推测其水体交换、流速等水动力和扩散条件较好,抑制了Chl.a的增长。较好的扩散条件使得TN、TP等营养物质在各样点之间分布更为均匀,因此,洞庭湖水环境异质性较低,而鄱阳湖水环境异质性较高。
3.2 两湖水体细菌群落组成的空间分布格局及影响因子
蓝细菌已成为目前世界范围内湖泊生态环境的重要威胁对象,在条件适宜时,极易发生水华等危害水生态健康的事件[19-21]。目前,除较为常见的微囊藻水华外[22-24],鱼腥藻[25]、气丝藻[26]等水华也逐渐在鄱阳湖不同区域暴发。鄱阳湖第二次科考结果显示,部分湖区已经出现了明显的水华现象,蓝藻(也称蓝细菌)已成为各受控湖汊和碟形湖的主要优势类群之一[27]。本次调查结果中,蓝细菌门在两湖各样点均有一定程度的分布,并且呈现出相似的空间分布格局。在洞庭湖中,蓝细菌门种类的分布不均匀,其中中游湖区相对丰度较高,达到32.84%,而下游湖区较低;
在鄱阳湖中,蓝细菌门相对丰度总体分布相对均匀,但是中部湖区样点仍最高。文献记载,洞庭湖水华主要发生在东部和西部湖湾区等水流较缓、水体交换率低的区域,过水河道区域则零星分布[28]。两湖中部湖区较上游和下游区域,湖面宽,流速缓,这也可能是蓝藻相对丰度较高的原因。张民等关于太湖蓝藻水华空间扩张的研究结果显示,水华由西北区梅梁湾区域逐渐扩张至中部湖区,营养盐的空间分布和水文气象是最主要的驱动因子[29]。近年来随着上游水利设施的建设和流域内工农业的发展,氮、磷浓度逐渐上升,两湖富营养化日益严重[30]。因此,过水河道,尤其是中部湖区蓝藻水华的潜在风险较大。有关部门应加强藻类监测和管理,减缓或避免进一步扩张。

3.3 两湖水体细菌群落构建机制
通过了解微生物群落变化的生态过程和影响因素,推断群落稳定性及其与生态系统功能之间的关系,有利于了解湖泊生态系统的变化过程及健康动态[1]。因此,探究湖泊水体细菌群落的构建机制是一项重要内容。洞庭湖和鄱阳湖属于典型的过水型湖泊,其水量主要由上游河流汇集,经湖区入长江,水体的流动对水体细菌的扩散分布影响较大,但是近年来两湖污染情况加剧,环境影响同样不容忽视。环境因子和空间因子是影响物种分布的两类关键因子,前者指示了环境条件的差异对群落中不同物种的选择作用,是一种确定性过程;
而空间因子主要通过扩散等作用影响物种在空间上的分布,是一种随机性过程。越来越多的研究表明,两者同时对物种的分布产生重要影响,研究的焦点在于哪种过程占主导地位以及如何量化两者贡献的大小[32]。
本次调查方差分解结果显示,洞庭湖以空间影响为主(42.0%),但其中有27.0%与环境影响重叠,而鄱阳湖则以环境影响为主(25.0%),仅6.0%与空间影响重叠。值得注意的是,两湖分别有55.0%和62.0%的变异不能被解释。零模型分析结果显示,随机性过程(包括漂变和同质扩散)主导了两湖水体细菌的空间分布(分别为58.5%和79.7%)。鄱阳湖的环境空间异质性较洞庭湖高(图2),若确定性过程主导,其物种组成相似度应该较低,但其物种组成分析结果显示较为聚集,即相似度较高(图6),说明鄱阳湖受到的随机过程影响高于洞庭湖,这与零模型分析结果一致。在确定性过程影响方面,洞庭湖受确定性影响相对比例较鄱阳湖大,且主要体现在同质选择作用上,同样与洞庭湖环境的空间异质性较低一致。零模型分析是基于群落中各物种的谱系关系和丰度信息,通过建立“随机群落”的方式,比较“观测群落”与“随机群落”之间的谱系组成关系,判断不同群落构建过程的比例[33],而方差分解则是基于典范分析或冗余分析通过排序得到[34],依赖于实测的环境因子和位点空间关系,在实际操作过程中,会有一部分方差无法解释,即残差。因此,本次研究中,零模型分析结果更好地解释了两湖水体细菌的群落构建机制。
综上所述,洞庭湖和鄱阳湖等过水型湖泊中生物群落的构建受到随机过程的重要影响,所观测群落特征与真实水生态健康状况之间存在较大的不确定性。因此,在水生态监测工作开展过程中,探究监测对象群落构建模式非常重要。
猜你喜欢两湖鄱阳湖洞庭湖鄱阳湖水系之潦河水利水电快报(2022年7期)2022-07-18洞庭湖小学生学习指导(低年级)(2021年10期)2021-11-01“两湖”公园空气负离子浓度时空变化特征经济研究导刊(2020年21期)2020-09-12轻松松聊汉语 洞庭湖金桥(2020年8期)2020-05-22《鄱阳湖生态系列插画》现代出版(2019年6期)2020-01-14鄱阳湖好风光老友(2017年4期)2017-02-09两湖文学:作为整体感觉文化区长江学术(2016年3期)2016-08-23好一个洞庭湖音乐天地(音乐创作版)(2016年4期)2016-07-28洞庭湖的麋鹿林业与生态(2016年3期)2016-02-27镇远·两湖会馆乡村地理(2015年3期)2015-11-10