郭治华,张荣,王煜
(中国医科大学附属盛京医院急诊科,沈阳 110004)
脓毒血症是一种由感染引起的生理、病理、生化异常的综合征,可导致多器官功能障碍,是重症监护病房患者的主要死亡原因。肺是脓毒血症时最易受损的靶器官,并且急性肺损伤(acute lung injury,ALI)发生的时间最早,发生率最高[1]。在脓毒症诱导ALI进展过程中,炎症和凋亡通路的异常活跃导致肺泡上皮细胞受损,上皮通透性增加,进而导致血管渗漏、炎症渗出,并最终引发急性呼吸窘迫综合征[2]。研究[3]表明,3-羟基-3-甲基戊二酰辅酶A(hydroxy-methyl-glutaryl coenzyme A,HMG-CoA)还原酶抑制剂(他汀类药物)除具有降脂作用外,还具有抗炎、免疫调节以及改善血管内皮细胞功能的作用。因此,本研究旨在探讨辛伐他汀对脓毒血症大鼠肺损伤的保护作用及其主要机制。
1.1 实验动物
将36只健康且不携带特异性病原体的成年雄性Wistar大鼠(体质量120 g±20 g,中国医科大学附属盛京医院本溪基地动物实验中心)随机分为假手术组、脓毒血症组和治疗组3组,每组12只。本研究获得中国医科大学附属盛京医院动物实验伦理委员会批准。
1.2 脓毒血症动物模型构建及处理
采用盲肠结扎穿刺术(cecal ligation and puncture,CLP)诱导大鼠脓毒血症模型[4]。腹腔注射5%水合氯醛(0.6 mL/100 g)麻醉大鼠,沿腹中线切口暴露盲肠,用5-0丝缝线结扎盲肠中点处。用pH 7.4磷酸的盐缓冲液PBS浸泡盲肠,18号针头由肠系膜侧向非肠系膜侧刺穿盲肠。然后,将盲肠放回腹腔,缝合腹部切口。假手术组仅开腹,不进行盲肠结扎和穿孔,其余操作与其他2组相同。建模前1周进行预处理:治疗组小鼠腹腔注射辛伐他汀0.2 μg/g(由辛伐他汀5 mg+0.5 mL无水乙醇+0.9%氯化钠溶液500 mL配制,注射体积 0.02 mL/g),每12 h 1次,连续注射1周;
假手术组和脓毒血症组腹腔注射安慰剂 0.02 mL/g(由0.5 mL无水乙醇+0.9%氯化钠溶液500 mL配制),每12 h 1次,连续注射1周。于建模后24 h取材,用于下一步实验。
1.3 支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)中肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和脂钙蛋白2(lipocalin 2,LCN2)的检测
分离大鼠气管及主支气管后进行气管插管,0.5 mL预冷PBS灌洗左肺3次,收集BALF。BALF 1 500g,4℃,离心10 min,收集上清液。蛋白定量试剂盒(Bio-Rad Co.,美国)对BALF中蛋白含量进行测定,严格按照试剂盒说明书操作。酶联免疫吸附(enzyme linked immunosorbent assay,ELISA)试剂盒(R&D Systems Inc.,美国)检测BALF中TNF-α和LCN2的浓度。BALF中的细胞进行瑞氏吉姆萨染色后,利用光学显微镜进行多形核中性粒细胞(polymorphonuclear neutrophils,PMN)计数。
1.4 肺组织氧化应激检测
取左肺组织匀浆,1 500g,4 ℃,离心15 min。采用硫代巴比妥酸法测定上清中丙二醛(malondialdehyde,MDA)的水平,黄嘌呤氧化酶法测定超氧化物歧化酶(superoxide dismutase,SOD)活性。
1.5 肺水肿评价
采用湿重/干重(wet weight/dry weight,W/D)法评估肺水肿情况。建模24 h后,收集各组大鼠右肺上叶。滤纸吸走表面残余水分及血液,称质量(湿重);
然后,将肺组织在80 ℃下干燥24 h后,再称质量(干重)。最后计算肺组织W/D。
1.6 肺组织的病理学评估
取大鼠右肺中叶组织,预冷PBS冲洗3次,10%中性甲醛固定24 h。肺组织进行常规脱水、透明以及石蜡包埋。将石蜡包埋的肺组织进行4 μm连续切片后,二甲苯脱蜡,不同梯度浓度乙醇脱水,苏木精染色5 min,伊红染色2 min。光学显微镜下观察肺组织病理学变化。根据肺泡渗出物、肺间质充血水肿、中性粒细胞浸润、肺泡出血和细胞增生5项指标对肺组织结构完整性进行评估。每项指标分为无病变、轻度病变、中度病变和严重病变,得分依次为0、1、2和3分。各指标评分相加即为肺组织结构受损程度的总得分,得分越高表示受损越严重[5]。
1.7 统计学分析
采用SPSS 23.0软件进行数据的统计分析。计量资料以表示,组间比较采用单因素方差分析,两两比较采用LSD检验,P< 0.05为差异有统计学意义。
2.1 3组大鼠BALF中各检测指标比较
脓毒血症组BALF中总蛋白、LCN2和TNF-α水平及PMN计数均显著高于假手术组(均P< 0.05),治疗组BALF中上述各指标均明显低于脓毒血症组(均P<0.05),见表1。
表1 3组大鼠 BALF中总蛋白、TNF-α、LCN2水平及PMN计数比较()Tab.1 Comparison of total protein,TNF-α,and LCN2 concentrations and PMN count in BALF from rats in all groups()

表1 3组大鼠 BALF中总蛋白、TNF-α、LCN2水平及PMN计数比较()Tab.1 Comparison of total protein,TNF-α,and LCN2 concentrations and PMN count in BALF from rats in all groups()
1)P < 0.05 vs sham group;
2)P < 0.05 vs sepsis group.
2.2 3组大鼠肺组织MDA水平及SOD活性和肺水肿情况比较
与假手术组相比,脓毒血症组大鼠肺组织MDA水平显著升高,SOD活性则显著降低,W/D比值显著升高(均P< 0.05)。辛伐他汀治疗可显著降低肺组织MDA水平,提高SOD活性,降低W/D比值(均P<0.05),见表2。
表2 3组大鼠肺组织MDA水平、SOD活性及W/D比值比较()Tab.2 Comparison of MDA content,SOD activity,and W/D ratio in lung tissues from rats in all groups()

表2 3组大鼠肺组织MDA水平、SOD活性及W/D比值比较()Tab.2 Comparison of MDA content,SOD activity,and W/D ratio in lung tissues from rats in all groups()
1)P < 0.05 vs sham group;
2)P < 0.05 vs sepsis group.
2.3 3组大鼠肺组织病理学改变比较
HE染色结果显示,假手术组大鼠肺组织结构正常,肺泡形态清晰,无充血或水肿。脓毒血症组大鼠肺组织出现大量炎症细胞浸润,肺泡充血、水肿,肺泡壁增厚。辛伐他汀治疗可显著改善脓毒血症导致的炎症细胞浸润、肺泡充血和水肿现象(图1)。此外,假手术组、脓毒症组及治疗组肺组织病理评分分别为1.3±0.12、8.8±0.48和5.6±0.63,差异有统计学意义(P< 0.05)。
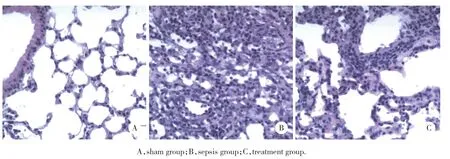
图1 光镜下3组大鼠肺组织HE染色×200Fig.1 H&E staining results of lung tissues from rats in all groups under light microscope × 200
ALI是脓毒血症最常见的组织损伤[6]。肺泡-毛细血管屏障的上皮和内皮层损伤和破坏,进而导致炎症细胞聚集到肺泡腔是ALI的典型特征[7]。本研究结果显示,脓毒血症导致大鼠支气管肺泡灌洗液中总蛋白量显著升高,表明内皮通透性增加;
支气管肺泡灌洗液中LCN2和TNF-α含量以及PMN计数升高,肺组织W/D比值升高,MDA升高和SOD活性下降,表明脓毒血症促进局部炎性细胞因子释放和中性粒细胞聚集,并提高氧化应激水平,继而导致肺水肿和肺实质损伤。辛伐他汀治疗显著降低了BALF中总蛋白、LCN2、TNF-α水平和PMN计数;
降低肺组织MDA水平,提高SOD活性;
降低肺W/D比值;
减轻肺组织炎症细胞浸润、肺间质充血和水肿。因此,辛伐他汀可能通过改善内皮屏障功能,减轻肺组织炎症反应和抑制过度氧化应激的途径减轻脓毒血症大鼠的ALI。
脓毒症时细菌毒素激活巨噬细胞/枯否细胞,诱导其释放促炎细胞因子及其他启动特异性免疫反应的炎症介质。此外,研究[8]表明,包括TNF-α和IL-6在内的促炎细胞因子在脓毒症导致的组织损伤中发挥重要作用。TNF-α可活化肺组织的中性粒细胞,促进其产生大量的包括颗粒酶、活性氧、生物活性脂类、多种促炎细胞因子等细胞毒性物质,启动炎症级联反应,进而造成组织损伤[9]。LCN2与乳铁蛋白、钙卫蛋白(S100A8/A9)或Mac-1(CD11b/CD18)一起储存于特异性颗粒中,促进中性粒细胞效应功能的发挥和迁移[10-11]。此外,LCN2可抑制卵巢透明细胞癌细胞内铁相关氧化应激反应[12],并高表达于臭氧诱导的受损肺组织中[13]。炎症状态下核转录因子NF-κB活化可刺激IL-6和LCN2表达增加[14]。本研究结果显示,TNF-α和LCN2等细胞因子在脓毒血症致肺损伤的发生中具有重要作用,辛伐他汀通过抑制多种炎性细胞因子的过量表达,对脓毒血症导致的ALI产生保护作用。
脂多糖可激活中性粒细胞、单核细胞/巨噬细胞,引起炎性细胞因子和氧自由基的过度释放,通过脂质过氧化反应,和直接对蛋白质、核酸的破坏,产生氧化应激损伤,引起细胞凋亡,导致脓毒血症ALI[15]。本研究结果显示,脓毒血症组大鼠肺组织MDA含量升高、SOD活性降低。光镜下,脓毒血症组大鼠肺组织病理损伤严重;
辛伐他汀治疗可显著降低肺组织MDA含量、增加SOD活性,减轻炎症细胞浸润和肺间质充血、水肿及肺组织病理损伤。提示辛伐他汀减轻脓毒血症大鼠ALI的机制与减轻氧化应激反应有关。
综上所述,辛伐他汀治疗能一定程度上减轻脓毒血症大鼠的肺损伤,其机制可能为辛伐他汀能够改善内皮通透性,降低肺组织炎症反应和氧化应激反应,从而减轻肺损伤,本研究为辛伐他汀用于临床治疗脓毒血症提供了理论基础。
猜你喜欢毒血症盲肠辛伐他汀鸡盲肠肝炎的流行病学、临床特征、实验室检查和防治措施现代畜牧科技(2021年5期)2021-07-20大鼠盲肠结扎穿刺脓毒症模型死亡率影响因素研究湖南畜牧兽医(2016年1期)2016-06-05羊肠毒血症的防与治兽医导刊(2016年12期)2016-05-17辛伐他汀对高血压并发阵发性心房颤动的作用及机制中国卫生标准管理(2015年17期)2016-01-20采用Illumina MiSeq测序技术分析断奶幼兔盲肠微生物群落的多样性动物营养学报(2015年9期)2016-01-07辛伐他汀联合曲美他嗪对糖尿病伴冠心病的影响中国当代医药(2015年17期)2015-03-01脑梗死应用辛伐他汀联合抗栓治疗的临床观察中国卫生标准管理(2015年13期)2015-01-26祛脂定斑汤联合辛伐他汀治疗颈动脉粥样硬化痰瘀互结型30例中医研究(2014年4期)2014-03-11一起山羊肠毒血症的诊断与防治云南畜牧兽医(2014年5期)2014-02-28羊肠毒血症的中西医治疗当代畜禽养殖业(2014年10期)2014-02-27